Quel planning pour le nouveau règlement DM ?
Cet article fait le point sur le planning du règlement DM : date de publication, de mise en œuvre, de notification des organismes, … pour vous aider à anticiper cette nouvelle règlementation.
Règlement DM & Calendrier
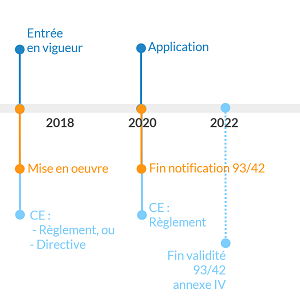
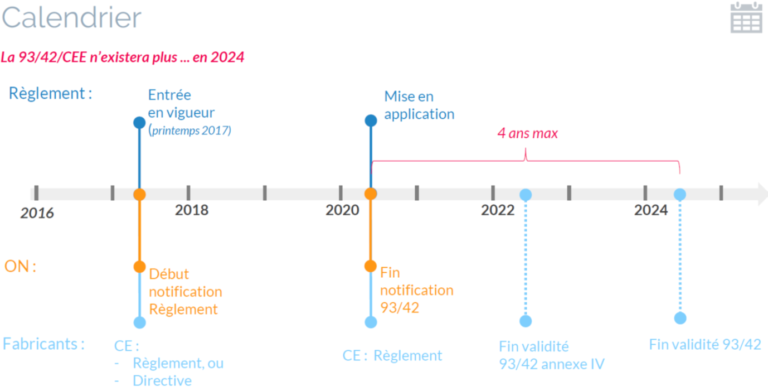
La chronologie est résumée ci dessous, elle reprend les informations de l’article 120 :
- Publication du règlement 2017/745 en mai 2017.
- il entre en vigueur quelques jours après publication au journal officiel.
- les organises notifiés commencent à être notifiés pour le nouveau règlement dès son entrée en vigueur.
- pendant 3 ans : les fabricants peuvent choisir une procédure de marquage CE selon la directive ou le règlement. Cela va énormément dépendre des notifications des ON. C’est la période de transition.
- mi 2020 :
- le règlement entre en application.
- fin de notification des ON pour la 93/42 => plus de certificat CE selon la directive.
- 2022 : le dernier certificat CE publié selon l’annexe IV n’est plus valable (tous les certificats selon l’annexe IV “vérification CE” tombent au plus tard deux ans après application du règlement).
- 2024 : tous les certificats selon la 93/42 ne sont plus valides.
- 2025 : fin de commercialisation des stocks de dispositifs certifiés selon la 93/42/CEE
Reformulation: en 2024 les fabricants ne peuvent plus proposer leurs DM certifiés selon la directive, en 2025 les distributeurs ne peuvent plus écouler leurs stocks.
Quel impact pour les fabricants ?
Tous les dispositifs médicaux devront être conformes au règlement :
- à partir de 2020 pour les nouveaux dispositifs.
- au plus tard en 2024 (et avant la fin de validité des certificats 93/42) pour les dispositifs déjà CE selon la directive, via un organisme notifié (pas de période de grace pour les DM classe I).
Les certificats de conformité selon le règlement pourront être émis dès 2017, ou plus précisément dès que les organismes notifiés seront prêts (au plus tôt à l’été 2019).
Vus les cycles dans le secteur (au moins 2 ans entre le début d’un projet et sa mise sur le marché) les nouveaux projets ont tout intérêt à prendre en compte la nouvelle règlementation dès maintenant, et ses conséquences sont lourdes et multiples (impact sur la classe, la documentation technique, l’évaluation clinique, …).
Quel impact pour les organismes notifiés ?
Bison futé voit rouge, en considérant :
- des temps de traitement plus long des dossiers (avec le règlement les dossiers techniques seront plus conséquents).
- des nouveaux produits inclus dans la règlementation (voir les dispositifs de l’annexe XVI soumis au règlement DM)
- l’abandon par certains organismes notifiés (ex : SNCH)
- un nombre important de dossiers à revoir pour tous les dispositifs médicaux déjà sur le marché.
=> gros embouteillages à venir, parlez-en à votre ON.

13 commentaires