Qualitiso • Le site des Dispositifs Médicaux
Bienvenue sur Qualitiso
Article au hasard
Contenu par sujets
Veille, normes et documents
Sélection d’articles
Templates
Forum
Réglement (ue) 2017/745
Sélection d’articles
Templates
Vidéos
Système de Management de la Qualité
Sélection d’articles
Templates
- 📄 Document • Manuel Qualité
- 📄 Document • Suivi des NC, CAPA
- 📄 Document • Suivi Des Actions
- 📅 Plan • Conception et Développement
- ▶️ Procédure • Approche par les Risques
- ▶️ Procédure • Audits
- ▶️ Procédure • Conception et Développement
- ▶️ Procédure • Gestion des Achats
- ▶️ Procédure • Gestion des Documents
- ▶️ Procédure • Gestion des Équipements
- ▶️ Procédure • Gestion des Exigences des Clients
- ▶️ Procédure • Gestion des Modifications
- ▶️ Procédure • Gestion des Ressources Humaines
- ▶️ Procédure • Identification et Traçabilité
- ▶️ Procédure • Infrastructures et Environnement de Travail
- ▶️ Procédure • Marketing et contact commercial
- ▶️ Procédure • Mesures, Analyse et Amélioration
- ▶️ Procédure • Non-Conformités et CAPA
- ▶️ Procédure • Production et Prestations de service
- ▶️ Procédure • Revue de Direction
- ▶️ Procédure • Service Après-Vente
- ▶️ Procédure • Validation de la Production
- ▶️ Procédure • Validation des Logiciels du SMQ
- 🔎 Revues • Conception et Développement
- ❎ Spécification • Exigences sur le Dispositif
Forum
Documentation Technique et Informations fournies
Sélection d’articles
Templates
Gestion des Risques et Aptitude à l’Utilisation
Sélection d’articles
- Introduction à la norme ISO 14971
- L’ISO 14971 à l’heure du règlement
- Le dossier de gestion des risques
- Guide pour construire une analyse des risques
- Identification des risques des DM
- Estimations et suivi des probabilités
- Résumé de la norme XP S99-223
- Visualisation des données pour l’analyse B/R
- Résumé de la norme IEC 62366-1
- Exemples d’erreurs d’IAU
Templates
- ▶️ Procédure • Gestion des Risques
- ▶️ Procédure • Analyse des Risques et du rapport B/R
- 📄 Document • Analyse des risques
- ▶️ Procédure • Ingénierie de l’Aptitude à l’Utilisation
- 📓 Dossier • Gestion des Risques
- 📅 Plan • Gestion des Risques
- 📅 Plan • Ingénierie de l’Aptitude à l’Utilisation
- 📓 Rapport • Évaluations d’IAU
- 🔎 Revues • Gestion des Risques
- 🔎 Revues • Ingénierie de l’Aptitude à l’Utilisation
Logiciel et Électronique
Sélection d’articles
- Logiciels médicaux et Règlement DM
- Résumé de la norme IEC 62304
- Cybersécurité des dispositifs médicaux
- Résumé de la norme IEC 82304-1
- Marquage CE d’un dispositif électro-médical
- Les classes, types et groupes de D-EM
- Résumé de la norme IEC 60601-1
- Résumé de la norme IEC 60601-1-11
- Mémo : Les alarmes des dispositifs médicaux
Templates
- ▶️ Procédure • Cycle de Vie du Logiciel
- ▶️ Procédure • Gestion de la Cybersécurité
- ▶️ Procédure • gestion de la Sécurité Électrique
- ❎ Exigences • Essais selon la norme 60601-1
- ❎ Spécification • Architecture Logicielle
- ❎ Spécification • Exigences Logiciel
- ❎ Spécification • Fichier de Configuration du Logiciel
- ❎ Spécification • Unités Logicielles
- 📅 Plan • Développement du Logiciel
- 📅 Plan • Test du Logiciel
- 📓 Rapport • Test du Logiciel
- 🔎 Revues • Gestion du Cycle de Vie du Logiciel
Evaluations Biologiques et Cliniques
Sélection d’articles
Templates
Post-Market
Sélection d’articles
Templates
- ▶️ Procédure • Suivi Clinique Après Commercialisation
- 🗃️ Codes IMDRF des Effets indésirables
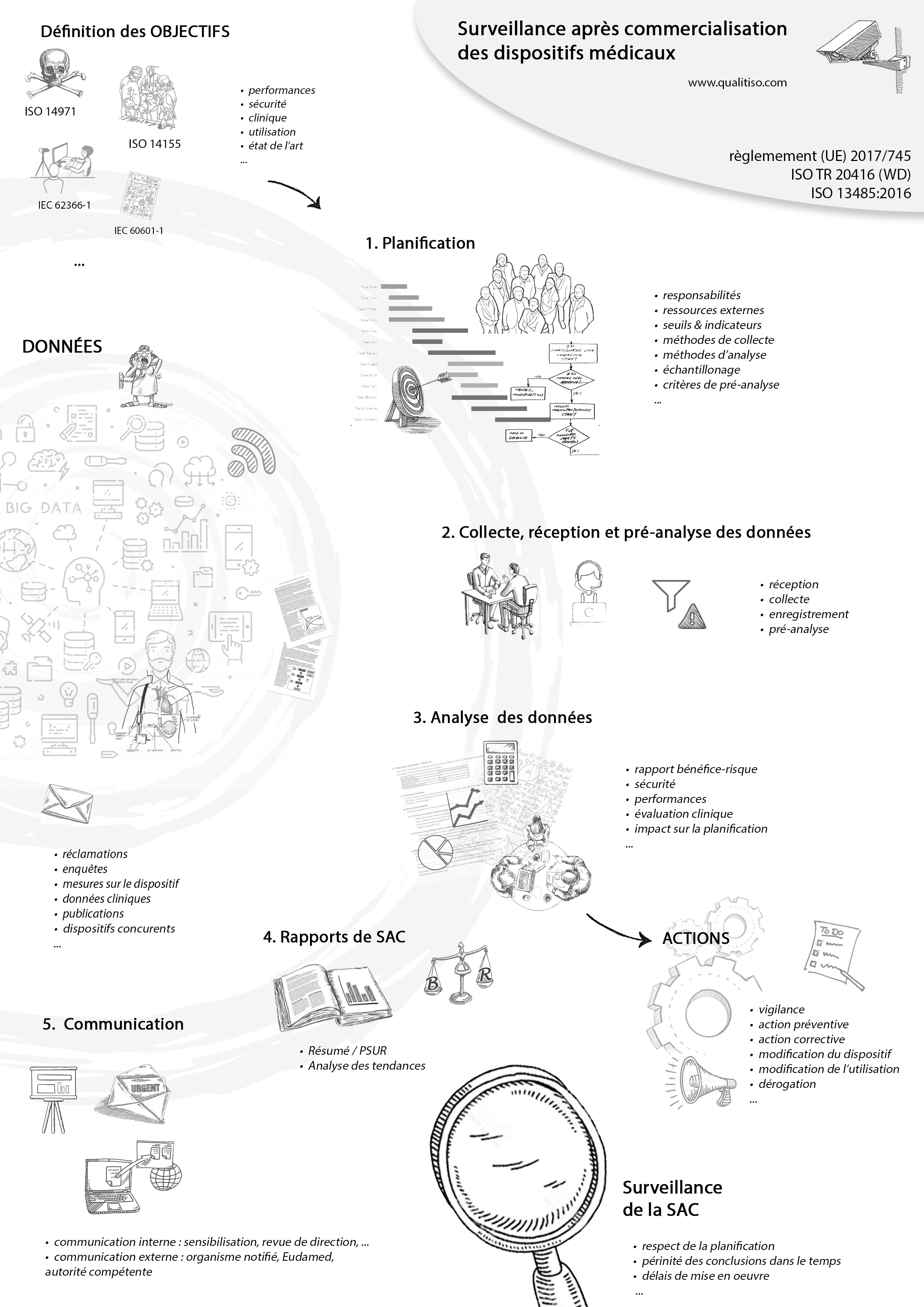
- ▶️ Procédure • Surveillance Après Commercialisation
- ▶️ Procédure • Vigilance
- 📅 Plan • Suivi Clinique Après Commercialisation
- 📅 Plan • Surveillance Après Commercialisation
- 📓 Rapport • Periodic Safety Update Report
- 📓 Rapport • Suivi Clinique Après Commercialisation
- 📓 Rapport • Surveillance Après Commercialisation
Autres sujets
Sélection d’articles
- Généralités sur la notion de Risque
- Covid-19 • Analyse et suivi dans le temps
- L’IA utilisée pour le médical
- L’impression 3D utilisée pour le médical
- Considérations environnementales les DM
- Les règlementations environnementales applicables
- Les normes pour le management environnemental
- Les principaux risques dans le monde
- Risques associés au changement climatique
- Un monde en 2100
Activité récente
accueil accueil
- Help. Accessoire or not accessoireon 13 Mai. 2025 at 14 h 18 min
Bonjour Le DM est une plateforme de télesurveillance classée en IIa. Elle peut fonctionner avec des DMs connectés (fournis pas d\'autres fabricants interopérabilité OK, et fonctionnement en bluetooth) grâce […]
- Guide ANSM sur les cas frontières MDR 2017/745 et IVDR 2017/746on 13 Mai. 2025 at 8 h 02 min
Résumé du guide ANSM sur les cas frontiètres
- Eudamap 2025on 13 Mai. 2025 at 5 h 23 min
Carte des opérateurs économiques enregistrés dans Eudamed
- Podcast 2025-3on 23 Avr. 2025 at 8 h 37 min
Les actualités de mars-avril en podcast
- UDI-DI et attestation de conformité DM de classe Ion 18 Avr. 2025 at 14 h 11 min
Bonjour Un de nos fournisseurs a fourni un certificat de conformité pour un DM de classe I . L\'UDI de base apparaissant sur le certificat de conformité du DM ( et dans EUDAMED) est différent de l\'UDI apparaissant […]
- Classificationon 11 Avr. 2025 at 9 h 10 min
Bonjour, Est-ce qu\'un chariot servant à stocker et distribuer des médicaments ou des pansements peut être classé DM (classe I) au sens du règlement 2017/745?
- discordance réglementation durée vie dmion 8 Avr. 2025 at 8 h 22 min
Je me permets de vous contacter concernant une discordance sur la réglementation pour la durée de vie des DMI : le règlement MDR 2017/745 article 18 demande au fabricant de préciser la durée de vie sur la carte […]
- De la balance commerciale des USA dans le secteur des dispositifs médicauxon 7 Avr. 2025 at 6 h 27 min
Revue de la balance commerciale des USA en matière de dispositifs médicaux et calcul de la taxe Donald.
- Commentaires sur I, IIa, IIb, III: Les classes de dispositifs médicaux par Cedric Cedricon 28 Mar. 2025 at 11 h 06 min
@ Guillaume, Merci
- Commentaires sur I, IIa, IIb, III: Les classes de dispositifs médicaux par Guillaume Proméon 27 Mar. 2025 at 7 h 20 min
En réponse à <a href="https://www.qualitiso.com/classification-europeenne-dispositifs-medicaux/#comment-109105">Cedric Cedric</a>. Bonjour, aucun monopole ni restriction
- Commentaires sur Validation des logiciels utilisés dans le SMQ par Guillaume Proméon 25 Mar. 2025 at 5 h 50 min
En réponse à <a href="https://www.qualitiso.com/validation-logiciels-sqm-13485/#comment-109103">Dyna BAH</a>. Bonjour, à moins qu'ils n'impactent la traçabilité ou la conformité règlementaire : il ne […]
- Commentaires sur Validation des logiciels utilisés dans le SMQ par Dyna BAHon 24 Mar. 2025 at 16 h 38 min
Bonjour, Est-ce que les logiciels de vente de type "pipedrive" doivent être validés s'ils permettent de générer tous les enregistrements liés au processus de vente (devis, facture...) Merci
- Arrêts de dispositifs médicaux : les déclarations en Franceon 24 Mar. 2025 at 8 h 24 min
Arrêts de DM en chiffres, selon les déclarations à l'ANSM depuis 2022.
- Déclarer l’arrêt d’un dispositif : les critères proposés par AESGP-COCIR-MedTechEuropeon 17 Mar. 2025 at 8 h 24 min
Avis de AESGP / COCIR / MedTechEurope sur les conditions menant à déclarer l'arrêt d'un DM dans le cadre de l'article 10a du RDM.
- Avis des groupes d’experts sur les évaluations cliniques : procédure et synthèse des opinionson 13 Mar. 2025 at 10 h 15 min
Article Qualitiso relatif aux opinions des groupes d'experts relatives aux rapports des organismes notifiés relatifs aux évaluations cliniques des fabricants.
- Certificats UE délivrés sous certaines conditions, l’avis de Team-NBon 13 Mar. 2025 at 9 h 09 min
Certificats UE délivrés sous certaines conditions : étude de Core-MD et mot de Team-NB.
- La norme ISO 13485 est en examen systématiqueon 10 Mar. 2025 at 10 h 00 min
Examen systématique de l'ISO 13485, donnez votre avis.
- Guide IMDRF sur la caractérisation des logiciels dispositifs médicaux dans le cadre de la gestion des risqueson 10 Mar. 2025 at 9 h 29 min
Guide IMDRF sur la caractérisation des logiciels dispositifs médicaux dans le cadre de la gestion des risques.
- Commentaires sur Podcast 2025-2 par Mathilde Béalon 9 Mar. 2025 at 9 h 42 min
Bravo surtout pour l'info Tech ;-). Petite précision, si l'article 16 a pour but ne pas beaucoup servir. tant mieux. La famille de norme IEC 60335-1 des appareils pour usages domestiques et commerciaux traitent bien […]
- Bilan du recours des ON aux groupes d’experts pour les évaluations cliniques. 2021-2023on 9 Mar. 2025 at 8 h 51 min
Chiffres 2021-2023 pour les procédures de consultation pour l'évaluation clinique (scrutiny process).
- Podcast 2025-2on 8 Mar. 2025 at 18 h 01 min
L'actualité du mois de février : Initiatives UE, Disponibilité des DM, ON, Évaluations cliniques, Normes ISO & Co.
- UDI - date butoir - DM classe 1on 5 Mar. 2025 at 11 h 55 min
Bonjour, Nous sommes fabricant de dispositifs médicaux de classe 1. Nous devons appliquer le 26 mai 2025 les codes UDI sur nos emballages. Nous avons du stock sur certaines références que nous n\'arriverons pas à […]
- ISO 15223-1/A1 – Symboles à utiliser avec les informations à fournir par le fabricanton 4 Mar. 2025 at 10 h 37 min
Publication de l'amendement 1 à la norme ISO 15223-1 (Symboles à utiliser avec les informations à fournir par le fabricant).